таблица. Растворимость веществ в воде
В повседневной жизни люди редко сталкиваются с чистыми веществами. Большинство предметов представляют собой смеси веществ.
Раствор — это однородная смесь, в которой компоненты равномерно смешались. Есть несколько их видов по размеру частиц: грубодисперсные системы, молекулярные растворы и коллоидные системы, которые часто называют золи. В этой статье речь идет о молекулярных (или истинных) растворах. Растворимость веществ в воде — одно из главных условий, влияющих на образование соединений.
Растворимость веществ: что это и зачем нужно
Чтобы разобраться в этой теме, нужно знать, что такое растворы и растворимость веществ. Простым языком, это способность вещества соединяться с другим и образовывать однородную смесь. Если подходить с научной точки зрения, можно рассмотреть более сложное определение. Растворимость веществ — это их способность образовывать с одним или более веществами гомогенные (или гетерогенные) составы с дисперсным распределением компонентов. Существует несколько классов веществ и соединений:
- растворимые;
- малорастворимые;
- нерастворимые.

О чем говорит мера растворимости вещества
Содержание вещества в насыщенной смеси — это мера его растворимости. Как сказано выше, у всех веществ она разная. Растворимые — это те, которые могут развести более 10 г себя на 100 г воды. Вторая категория — менее 1 г при тех же условиях. Практически нерастворимые — это те, в смесь которых переходит менее 0,01 г компонента. В этом случае вещество не может передавать воде свои молекулы.
Что такое коэффициент растворимости
Коэффициент растворимости (k) — это показатель, максимальной массы вещества (г), которая может развестись в 100 г воды или другого вещества.
Растворители
В данном процессе участвуют растворитель и растворенное вещество. Первый отличается тем, что изначально он пребывает в таком же агрегатном состоянии, что и конечная смесь. Как правило, он взят в большем количестве.
Однако многие знают, что в химии вода занимает особое место. Для нее существуют отдельные правила. Раствор, в котором присутствует H2O называется водным. Когда говорится о них, жидкость является экстрагентом и тогда, когда она в меньшем количестве. В пример можно привести 80%-ный раствор азотной кислоты в воде. Пропорции здесь не равны Хоть доля воды меньше, чем кислоты, вещество называть 20%-ным раствором воды в азотной кислоте некорректно.
Существуют смеси, в которых отсутствует H2O. Они будут носить имя неводная. Подобные растворы электролита представляют собой ионные проводники. Они содержащие один или смеси экстрагентов. В их состав входят ионы и молекулы. Они используются в таких отраслях, как медицина, производство бытовой химии, косметики и в другие направления. Они могут сочетать в себе несколько нужных веществ с различной растворимостью. Компоненты многих средств, которые применяются наружно, являются гидрофобными. Иными словами, они плохо взаимодействуют с водой. В таких смесях растворители могут быть летучими, нелетучими и комбинированными. Органические вещества в первом случае хорошо растворяют жиры. К летучим относятся спирты, углеводороды, альдегиды и другие. Они часто входят в состав бытовой химии. Нелетучие чаще всего применяются для изготовления мазей. Это жирные масла, жидкий парафин, глицерин и прочие. Комбинированные — это смесь летучих и нелетучих, например, этанол с глицерином, глицерин с димексидом. Также они могут содержать воду.
Виды растворов по степени насыщенности
Насыщенный раствор — это смесь химических веществ, содержащая максимальную концентрацию одного вещества в растворителе при определенной температуре. Дальше оно разводиться не будет. В препарате твёрдого вещества заметно выпадение осадка, который находится в динамическом равновесии с ним. Под этим понятием подразумевается состояние, сохраняющееся во времени вследствие его протекания одновременно в двух противоположных направлениях (прямая и обратная реакции) с одинаковой скоростью.
Если вещество при постоянной температуре все еще может разлагаться, то этот раствор — ненасыщенный. Они устойчивы. Но если в них продолжать добавлять вещество, то оно будет разводиться в воде (или другой жидкости), пока не достигнет максимальной концентрации.
Еще один вид — перенасыщенный. В нем содержится больше растворенного вещества, чем может быть при постоянной температуре. Из-за того, что они находятся в неустойчивом равновесии, при физическом воздействии на них происходит кристаллизация.
Как отличить насыщенный раствор от ненасыщенного?
Это сделать достаточно просто. Если вещество — твердое, то в насыщенном растворе можно увидеть осадок. При этом экстрагент может загустевать, как, например, в насыщенном составе вода, в которую добавили сахар.
Но если изменить условия, повысить температуру, то он перестанет считаться насыщенным, так как при более высокой температуре максимальная концентрация этого вещества будет другой.
Теории взаимодействия компонентов растворов
Существует три теории относительно взаимодействия элементов в смеси: физическая, химическая и современная. Авторы первой — Сванте Август Аррениус и Вильгельм Фридрих Оствальд. Они предположили, что вследствие диффузии частицы растворителя и растворённого вещества равномерно распределились по всему объему смеси, но взаимодействия между ними нет. Химическая теория, которую выдвинул Дмитрий Иванович Менделеев, ей противоположна. Согласно ей, в результате химического взаимодействия между ними формируются неустойчивые соединения постоянного или переменного состава, которые называются сольваты.
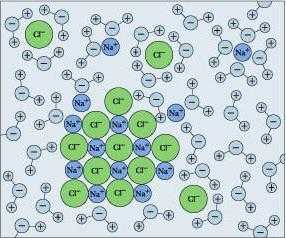
В настоящее время используется объединенная теория Владимира Александровича Кистяковского и Ивана Алексеевича Каблукова. Она совмещает физическую и химическую. Современная теория гласит, что в растворе существуют как не взаимодействующие частицы веществ, так и продукты их взаимодействия — сольваты, существование которых доказывал Менделеев. В случае, когда экстрагент — вода, их называют гидратами. Явление, при котором образуются сольваты (гидраты) носит имя сольватация (гидратация). Она воздействует на все физико-химические процессы и меняет свойства молекул в смеси. Сольватация происходит благодаря тому, что сольватная оболочка, состоящая из тесно связанных с ней молекул экстрагента, окружает молекулу растворенного вещества.
Факторы, влияющие на растворимость веществ
Химический состав веществ. Правило «подобное притягивает подобное» распространяется и на реагенты. Схожие по физическим и химическим свойствам вещества могут взаимно растворяться быстрее. Например, неполярные соединения хорошо взаимодействуют с неполярными. Вещества с полярными молекулами или ионным строением разводятся в полярных, например, в воде. В ней разлагаются соли, щёлочи и другие компоненты, а неполярные — наоборот. Можно привести простой пример. Для приготовления насыщенного раствора сахара в воде потребуется большее количество вещества, чем в случае с солью. Как это понимать? Проще говоря, вы можете развести гораздо больше сахара в воде, чем соли.
Температура. Чтобы увеличить растворимость твердых веществ в жидкостях, нужно увеличить температуру экстрагента (работает в большинстве случаев). Можно продемонстрировать такой пример. Если положить щепотку хлорида натрия (соль) в холодную воду, то данный процесс займет много времени. Если проделать то же самое с горячей средой, то растворение будет проходить гораздо быстрее. Это объясняется тем, что вследствие повышения температуры возрастает кинетическая энергия, значительное количество которой часто тратится на разрушение связей между молекулами и ионами твёрдого вещества. Однако, когда повышается температура в случае с солями лития, магния, алюминия и щелочами, их растворимость понижается.
Давление. Этот фактор влияет только на газы. Их растворимость увеличивается при повышении давления. Ведь объём газов сокращается.
Изменение скорости растворения
Не стоит путать этот показатель с растворимостью. Ведь на изменение этих двух показателей влияют разные факторы.
Степень раздробленности растворяемого вещества. Этот фактор влияет на растворимость твердых веществ в жидкостях. В цельном (кусковом) состоянии состав разводится дольше, чем тот, который разбит на мелкие куски. Приведем пример. Цельный кусок соли будет растворяться в воде намного дольше, чем соль в виде песка.
Скорость помешивания. Как известно, этот процесс можно катализировать с помощью помешивания. Его скорость также важна, потому что чем она больше, тем быстрее растворится вещество в жидкости.
Для чего нужно знать растворимость твердых веществ в воде?
Прежде всего, подобные схемы нужны, чтобы правильно решать химические уравнения. В таблице растворимости есть заряды всех веществ. Их необходимо знать для правильной записи реагентов и составления уравнения химической реакции. Растворимость в воде показывает, может ли соль или основание диссоциировать. Водные соединения, которые проводят ток, имеют в своем составе сильные электролиты. Есть и другой тип. Те, которые плохо проводят ток, считаются слабыми электролитами. В первом случае компоненты представляют собой вещества, полностью ионизованные в воде. Тогда как слабые электролиты проявляют этот показатель лишь в небольшой степени.
Уравнения химической реакции
Есть несколько видов уравнений: молекулярный, полный ионный и краткий ионный. По сути последний вариант — сокращённая форма молекулярного. Это окончательный ответ. В полном уравнении записаны реагенты и продукты реакции. Теперь наступает очередь таблицы растворимости веществ. Для начала надо проверить, является ли реакция осуществимой, то есть выполняется ли одно из условий проведения реакции. Их всего 3: образование воды, выделение газа, выпадение осадка. Если два первых условия не соблюдаются, нужно проверить последнее. Для этого нужно посмотреть в таблицу растворимости и выяснить, есть ли в продуктах реакции нерастворимая соль или основание. Если оно есть, то это и будет осадок. Далее таблица потребуется для записи ионного уравнения. Так как все растворимые соли и основания — сильные электролиты, то они будут распадаться на катионы и анионы. Далее сокращаются несвязанные ионы, и уравнение записывается в кратком виде. Пример:
- K2SO4+BaCl2=BaSO4↓+2HCl,
- 2K+2SO4+Ba+2Cl=BaSO4↓+2K+2Cl,
- Ba+SO4=BaSO4↓.
Таким образом, таблица растворимости веществ — одно из ключевых условий решения ионных уравнений.
Подробная таблица помогает узнать, сколько компонента нужно взять для приготовления насыщенной смеси.
Таблица растворимости
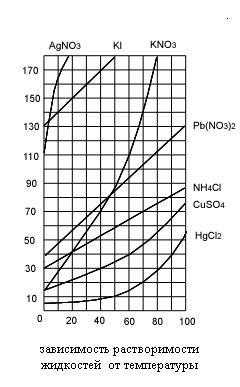
Так выглядит привычная неполная таблица. Важно, что здесь указывается температура воды, так как она является одним из факторов, о которых мы уже говорили выше.
Как пользоваться таблицей растворимости веществ?
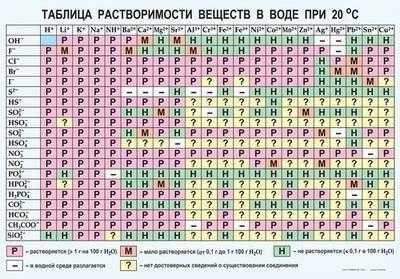
Таблица растворимости веществ в воде — один из главных помощников химика. Она показывает, как различные вещества и соединения взаимодействуют с водой. Растворимость твердых веществ в жидкости — это показатель, без которого многие химические манипуляции невозможны.
Таблица очень проста в использовании. В первой строке написаны катионы (положительно заряженные частицы), во второй — анионы (отрицательно заряженные частицы). Большую часть таблицы занимает сетка с определенными символами в каждой ячейке. Это буквы «Р», «М», «Н» и знаки «-» и «?».
- «Р» — соединение растворяется;
- «М» — мало растворяется;
- «Н» — не растворяется;
- «-» — соединения не существует;
- «?» — сведения о существовании соединения отсутствуют.
В этой таблице есть одна пустая ячейка — это вода.
Простой пример
Теперь о том, как работать с таким материалом. Допустим, нужно узнать растворима ли в воде соль — MgSo4 (сульфат магния). Для этого необходимо найти столбик Mg2+ и спускаться по нему до строки SO42-. На их пересечении стоит буква Р, значит соединение растворимо.
Заключение
Итак, мы изучили вопрос растворимости веществ в воде и не только. Без сомнений, эти знания пригодятся при дальнейшем изучении химии. Ведь растворимость веществ играет там важную роль. Она пригодится при решении и химических уравнений, и разнообразных задач.
fb.ru
Растворение. Растворимость веществ в воде
Растворы играют ключевую роль в природе, науке и технике. Вода – основа жизни, всегда содержит растворенные вещества. Пресная вода рек и озер содержит мало растворенных веществ, в то время как морская вода содержит около 3,5% растворенных солей.
Первичный океан (во время зарождения жизни на Земле), по предположениям, содержал всего 1% растворенных солей.
«Именно в этой среде впервые развивались живые организмы, из этого раствора они черпали ионы и молекулы, которые необходимы для их дальнейшего роста и развития… Со временем живые организмы развивались и преображались, поэтому они смогли оставить водную среду и перебраться на сушу и затем подняться в воздух. Они получили эти способности, сохранив в своих организмах водный раствор в виде жидкостей, которые содержат жизненно важный запас ионов и молекул» – именно такими словами описывает роль растворов в природе знаменитый американский химик, лауреат Нобелевской премии Лайнус Полинг. Внутри каждого из нас, в каждой клетке нашего организма – содержатся воспоминания о первичном океане, месте в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь.
В любом живом организме постоянно течет по сосудам – артериям, венам и капиллярам – необычный раствор, который составляет основу крови, массовая доля солей в нем такая же, как в первичном океане, – 0,9%. Сложные физико-химические процессы, протекающие в организме человека и животного, также взаимодействуют в растворах. Процесс усвоения пищи связан с переводом высокопитательных веществ в раствор. Природные водные растворы напрямую связаны с процессами почвообразования, снабжением растений питательными веществами. Такие технологические процессы в химической и многих других отраслях промышленности, например производство удобрений, металлов, кислот, бумаги, происходят в растворах. Современная наука занимается изучением свойств растворов. Давайте выясним, что же такое раствор?
Растворы отличаются от других смесей тем, что частицы составных частей располагаются в них равномерно, и в любом микрообъеме подобной смеси состав будет одинаков.
Именно поэтому под растворами понимали однородные смеси, которые состоят из двух или более однородных частей. Такое представление исходило из физической теории растворов.
Приверженцы физической теории растворов, которой занимались Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии.
Д. И. Менделеев и сторонники химической теории считали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Таким образом, будет точнее определить раствор как однородную систему, которая состоит из частиц растворенного вещества, растворителя, а также продуктов их взаимодействия.
Вследствие химического взаимодействия растворенного вещества с водой образуются соединения – гидраты. Химическое взаимодействие обычно сопровождается тепловыми явлениями. К примеру, растворение серной кислоты в воде проходит с выделением такого колоссального количества тепла, что раствор может закипеть, именно поэтому кислоту льют в воду, а не наоборот. Растворение таких веществ как хлорид натрия, нитрат аммония, сопровождается поглощением тепла.
М. В. Ломоносов доказал, что растворы превращаются в лед при более низкой температуре, чем растворитель.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
растворяется ли вещество в воде?
Смотря какое вещество…ну некоторые растворяются….))))))
смотри <a rel=»nofollow» href=»http://www.alhimik.ru/teleclass/konspect/konsp7-03.shtml» target=»_blank» >alhimik.ru — Растворимость веществ</a> а) хорошо растворимые, масса которых в насыщенном растворе соизмерима с массой воды (например KBr, при 20 °С растворимость 65,2 г / 100 г h3O; это 4,6М раствор) ; б) малорастворимые, масса которых в насыщенном растворе значительно меньше массы воды (например CaSO4, при 20 °С растворимость 0,206 г / 100 г h3O; это 0,015М раствор) ; в) практически нерастворимые, масса которых в насыщенном растворе пренебрежимо мала по сравнению с массой растворителя (например AgCl, при 20 °С растворимость 0,00019 г / 100 г h3O; это 0,0000134М раствор) .
смотря какое вещество))
touch.otvet.mail.ru
Уроки 27-29. Вода — растворитель. Растворы. Насыщенные и ненасыщенные растворы. Растворимость веществ в воде. Массовая доля растворенного вещества. Практическая работа ‘Приготовление раствора солей с определенной массовой долей вещества’ (Страницы 78,79,80,81)
Главная › 8 класс › Химия › Рабочая тетрадь по химии Боровских 8 классВода — универсальный растворитель. В ней растворяются многие твердые вещества (например: соль, сахар), жидкие вещества (например, кислоты (азотная, серная) и газообразные вещества (например, углекислый газ, сероводород). Именно поэтому в природе нельзя обнаружить чистую воду.
2. Растворами называют однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
3. Суспензия это смесь, в которой мелкие частицы твердого вещества равномерно распределены между молекулами воды.
4. Эмульсия — это смесь, в которой мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды (другой жидкости).
5. Растворимость — это макисмально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
Для большинства твердных веществ с повышением температуры растворимость увеличивается. Для газов растворимость увеличивается при понижении температуры.
6. Насыщенный раствор — это раствор, в котором данное вещество больше не растворяется при данной температуре.
Концентрированный растор — это раствор, в котором содержится много растворенного вещества.
Ненасыщенный раствор — это раствор, в котором данное вещество еще может настворяться.
Разбавленный раствор — это раствор, в котором содержится мало растворенного вещества.
7. Массовая доля вещества в растворе — это отношение массы растворенного вещества в массе раствора.
Формула:
8. Задача. Вычислите массу соли и воды для приготовления 250 г 5%-го раствора.

9. Задача. Вычислите массу кислоты и вода в 500 г 25%-го раствора.

10. Задача. Сколько (мл) воды надо взять, чтобы растворить 15 г хлорида меди (2) и получить 15%-ный раствор?

11*. Задача. Определите массу хлорида калия, содержащегося в 100 мл расвтора с массовой долей расвторенного вещества 20% (р=1,133 г/см3).

12*. Задача. Определите массу гидроксида натрия, содержащегося в 300 мл его 15%-ного раствора (р=1,165 г/мл).

Уроки 24-26. Водород, его общая характеристика и нахождение в природе. Получение водорода и его свойства. Применение водорода — стр. 72-77Практическая работа «Приготовление раствора солей с определенной массовой долей вещества» — стр. 82
Сохраните или поделитесь с одноклассниками:
dourokov.ru
Вода в химии
Вода как растворитель имеет громадное значение и в промышленности, и в быту. Трудно найти какое-нибудь производство, в котором вода не использовалась бы как растворитель. Возьмём, например, производство сахара. Горячая вода извлекает из тонких стружек сахарной свёклы сахар; затем после очистки раствор упаривается, и из него выделяются кристаллы сахара. Без воды работа сахарного завода немыслима. Невозможно себе представить выделку кожи, травление и крашение различных тканей, мыловарение и множество других производств без использования водных растворов различных веществ.
Вода как растворитель представляет особенно большой интерес для химии.
Химики очень часто применяют воду для очистки получаемых ими продуктов. Эта очистка основана на том, что большинство веществ растворяется в горячей воде лучше, чем в холодной. Так, например, в 100 граммах воды при температуре в 100 градусов растворяется 342 грамма едкого натрия, а при 20 градусах 109 граммов, при 100 градусах в том же количестве воды растворяется 291 грамм борной кислоты, а при 20 градусах около 40 граммов. Желая получить чистое вещество, поступают так. Загрязнённое вещество растворяют в воде до тех пор, пока не получится насыщенный раствор, т. е. такой, в котором вещество больше уже не растворяется. Затем фильтрованием удаляют нерастворимые примеси и охлаждают жидкость. При этом образуется пересыщенный раствор, из которого по мере понижения температуры выпадает всё больше и больше чистых кристаллов вещества. Растворимые же примеси остаются в растворе. Растворение и кристаллизацию повторяют несколько раз, в зависимости от того, насколько чистый продукт надо получить. Если растворимость изменяется с повышением температуры незначительно (как, например, у поваренной соли: при 100 градусах в 100 граммах воды растворяется 39,1 грамма соли, а при нуле градусов 35,6 грамма), растворы упаривают. Так получают, например, выварочную соль.
Однако вода ценна не только как средство для очистки веществ. Очень часто она играет незаменимую роль как единственно возможная среда для протекания тех или иных химических процессов.
Одним из условий возникновения реакции является столкновение участвующих в ней молекул. В случае, если взаимодействуют газообразные вещества или жидкости, такое столкновение осуществляется легко: молекулы газов и жидкостей достаточно подвижны. Но как провести реакцию между твёрдыми веществами? Ведь в них движение молекул весьма стеснено, так как каждая из молекул закреплена в определённом месте кристалла, где она может только колебаться. Вы можете насыпать в стакан немного соли и лимонной или щавелевой кислоты, но реакции между ними не дождётесь: эта смесь может простоять без всяких изменений сколь угодно долго. Как же быть? Здесь на помощь снова приходит вода. Прибавьте в тот же стакан воды. Сода и кислота растворятся в воде, и мельчайшие частички их получат возможность сталкиваться друг с другом. Между ними моментально начнётся химическая реакция, которую легко заметить по выделению из раствора пузырьков одного из продуктов реакции — углекислого газа.
Известно, что очень крепкую серную кислоту можно свободно перевозить в стальных цистернах — корпус цистерны ею не разрушается. Но если серная кислота разбавлена водой, стальные цистерны использовать уже нельзя, так как водный раствор серной кислоты легко разъедает железо.
Вещества не взаимодействуют друг с другом, если они не растворены, — гласит старинное правило химиков.
Вода отличается ещё одним важным свойством: она сама способна соединяться с очень многими веществами, быть активным участником различных химических процессов.
Вода способна соединяться с простыми веществами как металлами, так и неметаллами.
Например, неметалл хлор даёт с водой смесь кислот: соляную и хлорноватистую. Если хлор пропускать через воду, к которой прибавлен едкий натр, то в результате реакции получается «жавелевая вода», хорошее белящее средство.
С натрием, калием и некоторыми другими металлами вода бурно взаимодействует. При этом получаются едкие щёлочи и выделяется газ водород.
Вода вступает в реакции и со многими сложными веществами. Мы здесь укажем только несколько примеров этих реакций, приводящих к образованию очень важных в химической промышленности веществ — оснований (или гидроокисей) и кислот.
www.prostovoda.net
Растворяется ли сероводород в воде, и вредная ли такая вода для здоровья?
Айдар, привет! У тебя у родителей проблемы с водой? Пусть наливают воду в емкости с большой поверхностью и отстаивают ее в непыльном месте. Частично кипячение должно помочь (тоже в открытом сосуде) — при нагревании воды растворимость газов резко уменьшается. Сероводород улетучится. Да у вас там и родников подальше полно. А вообще-то этими «тухлыми яйцами» людей лечат. Например, в Бакирово, Ромашкино, Ямашнефти, Серноводске. Но каждый день все же лучше пить чистую воду.
Растворяется…. Сероводородная кислота получается. А в малых доза — в минеральной воде кое-где присутствует — в Кисловодстке, к примеру;)
Растворяется, насчёт здоровья каждому своё. Комуто и утюг грелка.
Сероводород растворим в воде 0.25 г на 100 мл воды. Минеральная вода Боржоми насыщена сероводородом. Сероводород полезен для здоровья (в малых дозах естественно) — расширяет сосуды, имеет противовоспалительное действие, активирует антиоксиданты.
Пить вредно, ванны — полезно.
touch.otvet.mail.ru
Вода — 100% растворитель!
Что может быть проще воды? Мы ее пьем, купаемся в ней, готовим с ее помощью. Наша жизнь была бы совершенно невозможна без нее. И в то же время эта «знакомая» вода – самое таинственное химическое вещество на планете.
«Живая» и «мертвая» вода, ее происхождение, причины перехода в другие агрегатные состояния – эти вопросы издавна интересовали людей. Одним из самых «чудесных» свойств воды является ее способность растворять вещества.
Фантастиче-
ская сила
Мы смотрим на горный источник и думаем: «Вот по-настоящему чистая вода!» Однако это не так: идеально чистой воды в природе не бывает. Дело в том, что вода является практически универсальным растворителем. В ней растворены газы: азот, кислород, аргон, углекислота – и другие примеси, находящиеся в воздухе. Особенно ярко свойства растворителя проявляются в морской воде, в которой растворяются практически все вещества. Принято считать, что в водах Мирового океана могут быть растворены практически все элементы таблицы периодической системы элементов. По крайней мере, на сегодня их обнаружено более 80, в том числе редкие и радиоактивные элементы. В наибольшем количестве в морской воде содержатся хлор, натрий, магний, сера, кальций, калий, бром, углерод, стронций, бор. Одного только золота растворено в Мировом океане по 3 кг на душу населения Земли!
В земной воде также всегда что-то растворено. Наиболее чистой считается дождевая вода, но и она растворяет в себе примеси, находящиеся в воздухе. Не думайте, что вода растворяет только легко растворимые вещества. К примеру, химики-аналитики утверждают, что вода немного растворяет даже стекло. Если растереть в ступке порошок стекла с водой, то в присутствии индикатора (фенолфталеина) появится розовая окраска – признак щелочной среды. Следовательно, вода частично растворила стекло и щелочь попала в раствор (недаром химики называют этот процесс выщелачиванием стекла).
Заниматель-
ная химия
Почему же вода может растворять столь различные вещества? Из курса химии мы знаем, что молекула воды электронейтральна. Но электрический заряд внутри молекулы распределен неравномерно: в области атомов водорода преобладает положительный заряд, в области, где расположен кислород, выше плотность отрицательного заряда. Следовательно, частица воды – это диполь. Этим свойством молекулы воды объясняется ее способность ориентироваться в электрическом поле и присоединяться к другим молекулам, несущим заряд. Если энергия притяжения молекул воды к молекулам какого-либо вещества больше, чем энергия притяжения между молекулами воды, то вещество растворяется. В зависимости от этого различают гидрофильные (хорошо растворимые в воде: соли, щелочи, кислоты) и гидрофобные (вещества, трудно или вовсе не растворимые в воде: жиры, каучук и др.). Таким образом, «вакциной» против растворения в воде является содержание в веществе жира. Неслучайно клетки человеческого тела имеют мембраны, содержащие жировые компоненты. Благодаря этому вода не растворяет тело человека, а способствует его жизнедеятельности.
Бетон и композит –
что прочнее?
Какое отношение эта информация имеет к бассейнам? Дело в том, что способность воды растворять многие вещества отрицательно влияет на бетонные бассейны. Вода необходима для гидратирования цемента. Однако после ее испарения в структуре бетона появляются пустоты и поры. Это приводит к увеличению проница- емости бетона для газов, пара и жидкости. В результате в поры бетонного бассейна попадает вода, он подвергается выщелачиванию и впоследствии попросту трескается.
Большим преимуществом по отношению к бетонным собратьям пользуются композитные бассейны. Композит – это неоднородный сплошной материал, состоящий из двух и более компонентов. Основную прочность изделиям из композита придает стекловолокно, то есть волокно из тонких стеклянных нитей. В такой форме стекло демонстрирует неожиданные свойства: не бьется, не ломается, а гнется без разрушения. В качестве связующего наполнителя в изготовлении композита применяются полимерные органические смолы, которые препятствую проникновению воды в поры вещества. Благодаря этому композитные бассейны практически не подвержены старению и устойчивы к воздействию всем необходимого, но столь разрушительного вещества – воды.
Похоже, что для всемогущей воды практически не существует препятствий. Со временем ей поддается абсолютно любой материал.
Но если необходимо выбрать материал для бассейна, то совершенно очевидно, какой из них: бетон или композит – будет Вашим надежным помощником в борьбе с разрушительной силой воды.
www.franmer.ru